ก๊าซ
ความสัมพันธ์ระหว่างอุณหภูมิ ความดัน และปริมาตรของแก๊ส
- ปริมาตร ความดัน และอุณหภูมิของแก๊ส มีความสัมพันธ์กันอย่างไร
(แก๊สต่างๆ นั้นจะมีความสัมพันธ์ระหว่าง ปริมาตร ความดัน และอุณหภูมิ อย่างใกล้ชิด โดยความสัมพันธ์จะแบ่งเป็นคู่ความสัมพันธ์ เมื่อให้ปริมาตรของแก๊สคงที่ตลอดการพิจารณา)
1) ปริมาตร- ความดัน ความสัมพันธ์นี้เสนอโดย รอเบิร์ต บอยล์ (Robert Boyle, 1662) กล่าวไว้ว่า “ เมื่ออุณหภูมิและจำนวนอนุภาคคงที่ ปริมาตรของแก๊สใดๆ จะแปรผกผันกับความดันของแก๊สนั้นๆ” ดังสมการ
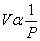
หรือ
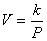
ดังนั้น PV = k
เมื่อ V คือ ปริมาตร
P คือ ความดัน
k คือ ค่าคงที่
2) อุณหภูมิ- ปริมาตร ความสัมพันธ์นี้ค้นพบโดย ชาร์ล (Jacques Charles, 1787) ที่กล่าวไว้ว่า “ เมื่อความดันและจำนวนอนุภาคคงที่ ปริมาตรของแก๊สใดๆ จะแปรผันตรงกับอุณหภูมิ เคลวิน” ดังสมการ
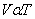
หรือ V = kT
ดังนั้น
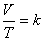

เมื่อ V คือ ปริมาตร
P คือ ความดัน
k คือ ค่าคงที่
3) อุณหภูมิ- ความดัน ความสัมพันธ์นี้ค้นพบโดย เกย์ - ลุสแซก (Joseph-Louis Gay-Lussac, 1802) ที่กล่าวไว้ว่า “ เมื่อปริมาตร และจำนวนอนุภาคคงที่ ความดันของแก๊สใดๆ จะแปรผันตรงกับอุณหภูมิเคลวิน” ดังสมการ
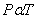
หรือ P = kT
ดังนั้น
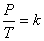
เมื่อ P คือ ความดัน
T คือ อุณหภูมิ
k คือ ค่าคงที่
จากกฎทั้งสาม เมื่อนำมารวมกันจะนำไปสู่กฎรวมของแก๊ส นั่นคือ
ดังนั้น
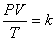
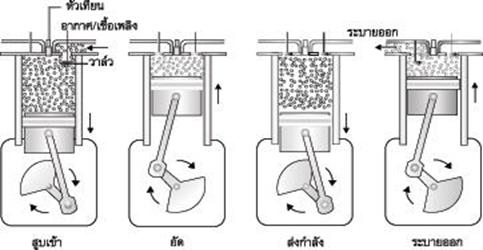
(การทำงานของลูกสูบ เริ่มจากการปล่อยให้ไอของเชื้อเพลิงไหลเข้าไปในกระบอกสูบ เมื่อกระบอกสูบอัดตัวเข้ามา หัวเทียนก็จะจุดระเบิดเชื้อเพลิงได้เป็นแก๊สคาร์บอนไดออกไซด์ และไอน้ำออกมาเป็นผลิตภัณฑ์ที่อุณหภูมิสูง ดังนั้นปริมาตรของกระบอกสูบก็จะขยายออกอีกครั้ง หลังจากนั้นจึงมีการระบายแก๊สออกไปยังท่อไอเสีย การทำงานที่สัมพันธ์กันนี้ เมื่อกระบอกสูบหดและขยายตัวสลับกันไป ก็จะทำให้ก้านสูบไปดันให้เกิดการหมุนของล้อและเพลาได้อย่างต่อเนื่อง)
สรุปทฤษฎีต่างๆ ของก๊าซ
- กฎของบอยล์ ( Boyle ‘s Law) “ เมื่ออุณหภูมิและมวลคงที่ ปริมาตรของก๊าซใด ๆ จะแปรผกผันกับความดัน”
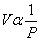 เมื่อ T และ คงท
เมื่อ T และ คงที่
P 1V 1 = P 2V 2
- กฎของชาร์ล ( Charle ‘s Law) “ เมื่อความดันและมวลของก๊าซคงที่ ปริมาตรของก๊าซจะแปรผันตรงกับคุณหภูมิเคลวิน”
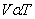 เมื่อ P และ nคงท
เมื่อ P และ nคงที่
- กฎของเกย์ลุสแสค ( Gay-Lussac ‘s Law) “ ความดันของก๊าซใดๆ จะแปรผันตรงกับอุณหภูมิเคลวินเมื่อปริมาตรและมวลของก๊าซคงที่”
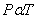 เมื่อ V และ n คงที่
เมื่อ V และ n คงที่กฎของก๊าซ สมบัติของแก๊สที่ได้จากการทดลองของนักวิทยาศาสตร์ทั้งสาม คือ บอยล์ ชาร์ล และเกย์-ลูสแซก นำมารวมกันเป็นกฎของแก๊ส จะได้กฎของแก๊ส คือ
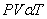 (เมื่อปริมาณหรือจำนวนโมเลกุลของแก๊สคงที่)
(เมื่อปริมาณหรือจำนวนโมเลกุลของแก๊สคงที่)และจะได้
จากความสัมพันธ์ ข้างต้นแสดงให้เห็นว่า
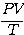
เป็นค่าคงที่ ซึ่งค่าคงที่ตัวนี้ขึ้นอยู่กับจำนวนโมเลกุลของแก๊สในภาชนะ (N) ทีใช้ทดลอง คือ ถ้าจำนวนโมเลกุลเปลี่ยนไปค่า
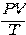
ต้องเปลี่ยนไปด้วย เช่น การรั่วของแก๊สจากลูกโป่งทำให้ปริมาตรของลูกโป่งลดลง และความดันภายในลูกโป่งลดลงด้วย
ให้ N เป็นจำนวนโมเลกุลของแก๊สในภาชนะ
ดังนั้น
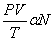
หรือ
เมื่อ KB คือ ค่าคงตัวของโลต์ซมัน์ (Boltzmann’s constant ) มีค่าเท่ากับ 1.38x10 -23 จูลต่อเคลวิน
ให้ n เป็นจำนวนโมลของก๊าซในภาชนะ
เนื่องจาก n = มวลของก๊าซ (m) / มวลโมเลกุลของแก๊ส (M)
หรือ
เมื่อ N A คือ เลขอาโวกาโดร (Avogadro’s number) มีค่าเท่ากับ 6.02x10 23 โมเลกุลต่อโมล
จะได้
หรือ PV = nRT
ดังนั้นสูตรที่เกี่ยวข้องกับโมลของแก๊ส PV = nRT
เมื่อ R= N AK B มีค่าเท่ากับ 8.314 จูลต่อโมล-เคลวิน เรียกว่า ค่าคงตัวของแก๊ส
ตัวอย่างที่ 1 5 อากาศซึ่งอยู่ในห้องที่มีขนาด 50 ลูกบาศก์ อุณหภูมิเพิ่มขึ้นจาก 0 องศาเซลเซียสเป็น 27 องศาเซลเซียส จงหาว่าอากาศจะรั่วออกไปจากห้องกี่กิโลกรัม กำหนดความหนาแน่นของอากาศที่ 0 องศาเซลเซียสเท่ากับ 1.3 กิโลกรัมต่อลูกบาศก์เมตร
วิธีทำ จากกฎของแก๊ส

ในที่นี้ความดันของอากาศในห้องต้องคงตัว จะได้
p 1 T 1 = p 2 T 2
p 2 = ( 1.3x273)/300
= 1.18 kg/m 3
มวลของอากาศที่รั่วออกไปจากห้อง = m 1-m 2= ( p 1 - p 2 ) V = (1.3 – 1.18)50
= 5.85 kg.
ดังนั้น อากาศจะรั่วออกไปจากห้องเท่ากับ 5.85 กิโลกรัม ตอบ
- กฎความดันย่อยของดาลตัน ( Dalton ‘s Law of Partial Pressure)
P t = P 1 + P 2 + P 3 + P 4 + ……..
P t = ความดันรวมของก๊าซผสม
- ทฤษฎีจลน์ของก๊าซ
- ก๊าซประกอบด้วยโมเลกุลขนาดเล็กมากและอยู่ห่างกัน
- ไม่มีแรงยึดเหนี่ยวระหว่างโมเลกุลของก๊าซ
- โมเลกุลของก๊าซเคลื่อนที่ตลอดเวลาโดยเป็นเส้นตรง
- เมื่อโมเลกุลชนกันจะไม่มีการสูญเสียพลังงานจลน์
- พลังงานจลน์เฉลี่ยของก๊าซแปรผันตรงกับอุณหภูมิเคลวิน และที่อุณหภูมิเดียวกันก๊าซทุกชนิดมีพลังงานจลน์เฉลี่ยเท่ากัน
พลังงานจลน์เฉลี่ย = 1/2 mv 2
= 3/2 kT
k = ค่าคงที่ของ Botzman
= 1.39 X 10 -23 J/K.mol
การแพร่ของแก๊ส
เรื่องการแพร่ของแก๊สนี้สามารถแสดงให้เห็นได้ง่ายๆ โดยอาศัยแก๊สที่มีสี อาจจะใช้เกล็ดไอโอดีนให้ระเหิดและกระจายตัวออกไปก็ได้ เพื่อให้นักเรียนได้เห็นถึงการเคลื่อนที่ของแก๊สว่ามี ทิศทางอย่างไร ได้อย่างชัดเจน และเข้าใจได้มากขึ้น หรืออาจทดลองได้ง่ายๆ โดยใช้สารละลาย แอมโมเนียเข้มข้น (conc NH 3) กับสารละลาย กรดไฮโดรคลอริกเข้มข้น (conc HCl) โดยใช้ไม้พันสำลีชุบสารละลายแอมโมเนียเข้มข้น และไม้พันสำลีชุบสารละลายกรดไฮโดรคลอริก เข้มข้น นำไม้พันสำลีทั้งสองไปปิดที่ปลายของหลอดแก้วปลายเปิดทั้งสองด้าน ดังภาพ
สารละลายกรด
ไฮโดรคลอริก (HCI ) | | |
|
| | | เกลือแอมโมเนียคลอไรด์ สารละลายกรดแอมโมเนีย
(NH 4CI ) (NH 3 ) |
การทดลองเรื่องการแพร่ของแก๊ส |
เนื่องจากทั้งสารละลายแอมโมเนียเข้มข้นและสารละลายกรดไฮโดรคลอริกเข้มข้นกลายเป็น
ไอได้ง่าย ( ไอแอมโมเนียและไอไฮโดรเจนคลอไรด์) ไอที่เกิดขึ้นจะแพร่ไปตามหลอดแก้ว เมื่อไอทั้งสองสัมผัสกัน ก็จะเกิดปฏิกิริยากลายเป็นแอมโมเนียมคลอไรด์ ซึ่งสังเกตได้เพราะเป็นของแข็งสีขาว แล้ววัดระยะของของแข็งจะพบว่าแก๊สแอมโมเนียแพร่มาได้ไกลกว่า เนื่องจากมวลโมเลกุลน้อยกว่านั่นเอง ( มวลโมเลกุลของแอมโมเนีย คือ 17 และมวลโมเลกุลของกรดไฮโดรคลอริก คือ 36.5)
- กฎการแพร่ของก๊าซของเกรแฮม (Graham ‘s Law of Diffusion of Gas)
“ เมื่ออุณหภูมิและความดันคงที่ การแพร่ของก๊าซใด ๆ จะแปรผกผันกับรากที่ 2 ของมวลโมเลกุล หรือความหนาแน่นของก๊าซนั้น
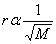
หรือ
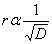
r = อัตราการแพร่ของก๊าซ
M = มวลโมเลกุลของก๊าซ
D = ความหนาแน่นของก๊าซ
หน่วยต่าง ๆ ที่เกี่ยวกับก๊าซ
ปริมาตร 1 ลิตร = 1 dm 3
= 1000 มิลลิลิตร
= 1000 CC.
= 1000 cm3
ความดัน 1 บรรยากาศ = 760 มม. ปรอท
= 76 ซม. ปรอท
= 760 ทอร์
= 14.7 ปอนด์/ ตารางนิ้ว
ความดันย่อยของแก๊สผสม
ความดันของแก๊สผสม ย่อมเกิดจากความดันย่อยของแก๊สแต่ละชนิด อาจจะยกตัวอย่างให้เห็นได้ง่ายๆ โดยอาศัยอากาศมาอธิบาย เนื่องจากอากาศเองก็มีความดัน และองค์ประกอบของอากาศก็มีมากมายอันได้แก่ แก๊สชนิดต่างๆ เช่น ไนโตรเจน ออกซิเจน คาร์บอนไดออกไซด์ เป็นต้น
ตาราง ร้อยละของแก๊สองค์ประกอบในบรรยากาศโลก
แก๊ส | ร้อยละโดยปริมาตรของแก๊สองค์ประกอบในบรรยากาศโลก |
ไนโตรเจน ( N2 )
ออกซิเจน ( O2 )
คาร์บอนไดออกไซด์ ( CO2 )
อาร์กอน ( Ar )
ไอน้ำ ( H 2O )
คาร์บอนมอนนอกไซต์ ( CO )
นีออน ( Ne ) | 78.80
20.95
0.036
0.930
0-4
น้อยมาก
0.002 |
ความดันบรรยากาศ เกิดจากความดันย่อยของแก๊สแต่ละชนิดรวมกันนั่นเอง
 .........................................
.........................................